 |
|
Prof.Dr.Ahmet Rasim Küçükusta Sosyal medya üzerinden uluslar arası tıbbi verilerin yer aldığı makaleyi ''Müjdemi İsterim hücresel bağışıklık oluşuyor.Tıpki 17 yıl önce SARS geçirenlerde hala gösterilebilen bağışıklık gibi. ''Başlığı altında paylaşırken konuyla ilgili açıklayıcı bilgiler verdi .
Prof.Dr.Rasim Küçükusta Kovid geçirenlerde antikorların azalması dert deyil,çünkü hem antikor yapan hafıza plazma hücreleri, hemde senelerce süren (belki ömür boyu )hücresel bağışıklık oluşuyor.Tıpki 17 yıl önce SARS geçirenlerde hala gösterebilen bağışıklık gibi.
KOVİD geçiren ve antikor tespit edilemeyen bazı hastalarda güçlü ve koruyucu katil bağışıklık hücreleri olduğu görüldü diyerek bilgi verdi.
İŞTE ULUSLARARASI TIBBI DERGİDE YAYINLANAN KOVİD GEÇİRENLERDE ÖMÜR BOYU BAĞIŞIKLIK KAZANILDIĞI KONU OLAN O MAKALENİN TÜRKÇE AÇIKLAMASI (BYTURCO YAYIN GRUBU EKİBİMİZ SİZİN İÇİN HAZIRLADI )
Önceden var olan ve indüklenmiş SARS-CoV-2'ye özgü CD8 + T hücrelerinin karakterizasyonu
Ortaya çıkan veriler, farklı viral proteinleri hedefleyen SARS-CoV-2'ye özgü CD8 + T hücrelerinin, iyileşen bireylerin 1 , 2 , 3 , 4 , 5'e kadar% 70'inde tespit edilebildiğini göstermektedir . Bununla birlikte, SARS-CoV-2 enfeksiyonunun doğal seyri sırasında önceden var olan ve indüklenen SARS-CoV-2'ye özgü CD8 + T hücre yanıtlarının bolluğu, fenotipi, fonksiyonel kapasitesi ve kaderi hakkında şu anda çok az bilgi mevcuttur . Burada, bir dizi optimal ve baskın SARS-CoV-2'ye özgü CD8 + T hücresi epitopları tanımlıyoruz . Ayrıca önceden var olan ve indüklenmiş SARS-CoV-2'ye özgü CD8 + 'nın yüksek çözünürlüklü bir ex vivo analizini gerçekleştiriyoruz.Peptit yüklü majör histo-uyumluluk kompleksi sınıf I (pMHCI) tetramer teknolojisini uygulayan T hücreleri. SARS-CoV-2 enfeksiyonunu takiben enine kesitsel olarak analiz edilen ve T hücreleri için uzunlamasına değerlendirilen üç kişide hızlı indüksiyon, uzun süreli kasılma ve heterojen ve fonksiyonel olarak yetkin çapraz reaktif ve indüklenmiş hafıza CD8 + T hücre yanıtlarının ortaya çıktığını gözlemliyoruz. SARS-CoV-2 enfeksiyonu öncesi ve sonrası. SARS-CoV-2'ye özgü bellek CD8 + T hücreleri, influenzaya özgü CD8 + ile karşılaştırılabilir işlevsel özellikler sergilemiştir.T hücreleri ve sivri uç (S) ve nükleoproteini (N) hedefleyen anti-SARS-CoV-2 antikorları için seronegatif olan SARS-CoV-2 iyileşen bireylerde tespit edilebilirdi. Bu sonuçlar, çapraz reaktif ve indüklenmiş SARS-CoV-2'ye özgü CD8 + T hücre yanıtlarını, hafif SARS-CoV-2 enfeksiyonunda bağışıklık korumanın potansiyel olarak önemli belirleyicileri olarak tanımlar .
Ana
Dünya çapındaki çoğu popülasyonda yaygın olan aşağıdaki insan lökosit antijeni (HLA) sınıf I allellerinin her biri için siliko olarak tahmin edilen, SARS-CoV-2'den türetilmiş epitop aday peptidlerinden beşini seçtik (Genişletilmiş Veri Şekil 1 ): A * 01: 01, A * 02: 01, A * 03: 01, A * 11: 01 ve A * 24: 02'nin yanı sıra B * 07: 02, B * 08: 01, B * 15: 01 ve B * 40:01 ve B * 44: 02/03 için sekiz epitop aday peptidi (Ek Tablo 1 ). Ek olarak, SARS-CoV-2 6'da % 100 homoloji sergileyen daha önce tarif edilen SARS-CoV-1'e özgü CD8 + T hücresi epitoplarının hepsini dahil ettik (Ek Tablo 1 ). Bu 66 epitop peptidi, iyileşen hafif SARS-CoV-2 enfeksiyonu olan 26 kişide (beyaz soydan) test ettik (Ek Tablo 2) HLA uyumlu peptide özgü hücre kültürlerinde. Önemlisi, dört epitopluk bir medyanı hedefleyerek 26 kişiden 23'ünde (% 88,5) SARS-CoV-2'ye özgü CD8 + T hücre yanıtlarını tespit edebildik (aralık 1-12; Şekil 1a ). Bu, T hücresi uyarımı 1 , 2 , 3 , 4 , 5 için peptit havuzlarını kullanan farklı kohortlarda iyileşen bireylerin% 70'ine kadar daha önce bildirilen yüksek T hücresi tepkileri tespit oranını aşıyor ve muhtemelen rekabetçi olmayan yaklaşımımızı yansıtıyor. Tanımlanan CD8 + T hücresi epitopları, hem HLA tipleri, HLA-A hem de HLA-B ile kısıtlandı (Şekil 1b). Çalışmamızda tahmin edilen 53 SARS-CoV-2'ye özgü epitop adayının otuz üçü (% 62.3) doğrulanabilir (Ek Tablo 1 , kalın olarak gösterilmiştir). En güçlü yanıtlar, interferon üreten CD8 + T hücrelerinin % 8.3, 8.4 ve 62.6'sının medyanları ile A * 01 / ORF3a 207–215 , A * 02 / ORF3a 139–147 ve B * 07 / N 105–113 epitopları için gözlendi (IFN) -γ, sırasıyla peptide özgü kültürden sonra (Şekil 1c, d ). Protein uzunluğunu hesaba katarak, N- ve ORF3a'ya özgü CD8 + T hücresi yanıtlarının aşırı temsilini gözlemledik (Şekil 1e ). Buna rağmen, saptanabilir yanıtların mutlak çoğunluğu (57/110,% 51,8) ORF1ab'yi hedefledi (Şekil.1e ). Bu bulgu, SARS-CoV-2'nin virüse özgü CD8 + T hücreleri tarafından daha önceki çalışma 1'de gösterilen geniş çapta tanınmasını vurgulamaktadır . Optimal CD8 + T hücre epitoplarını tanımlama yaklaşımımız, örtüşen peptidler 1 , 5 , 7'yi kullanan çalışmaların aksine tüm viral genomu tamamen kapsamaması ve bu nedenle genel immünodominans değerlendirmesine izin vermemesi sınırlamasına sahiptir . Dikkat çekici bir şekilde, anti-SARS-CoV-2 S ve N immünoglobulin-G (IgG) için seronegatif olan sekiz iyileşme döneminde olan bireyde SARS-CoV-2'ye özgü CD8 + T hücresi yanıtlarını tespit edebildik (Şekil 1f). Tanımlanmış SARS-CoV-2'ye özgü CD8 + T hücresi epitoplarının SARS-CoV-2'ye maruz kalan bireylere özgü olup olmadığını belirlemek için , cinsiyete sahip 25 sağlıklı gönüllüden oluşan bir kohorttan (Ağustos 2019'dan önce elde edilen) tarihi kan örneklerini test ettik. SARS-CoV-2 kohortumuzla karşılaştırılabilir yaş ve HLA tipi özellikleri (Ek Tablo 2 ). Altı kişide (beş kişi, tek yanıt; bir kişi, beş yanıt) çok düşük virüse özgü IFN-γ + ve tümör nekroz faktörü pozitif (TNF + ) CD8 + T hücre yanıtları gözlemledik (Şekil 1g , Ek Tablo 1 ve Genişletilmiş Veriler Şekil 2a) ve ek dört kişide IFN-γ yanıtları olmayan TNF (Genişletilmiş Veri Şekil 2a, c ). Birden fazla SARS-CoV-2-naif bireyde IFN-y salgılayan CD8 + T hücreleri tarafından hedeflenen tek epitop , epitop B * 07 / N 105-113'tür (Genişletilmiş Veri Şekil 2a ). Bu, SARS-CoV-2 ve 'soğuk algınlığı' koronavirüsleri arasında en yüksek korumaya sahip, çalışmamızdaki SARS-CoV-2'ye özgü epitoptur (Genişletilmiş Veri Şekil 2b ve Ek Tablo 3 ).
Şekil 1: Dominant SARS-CoV-2'ye özgü CD8 + T hücresi epitopları.
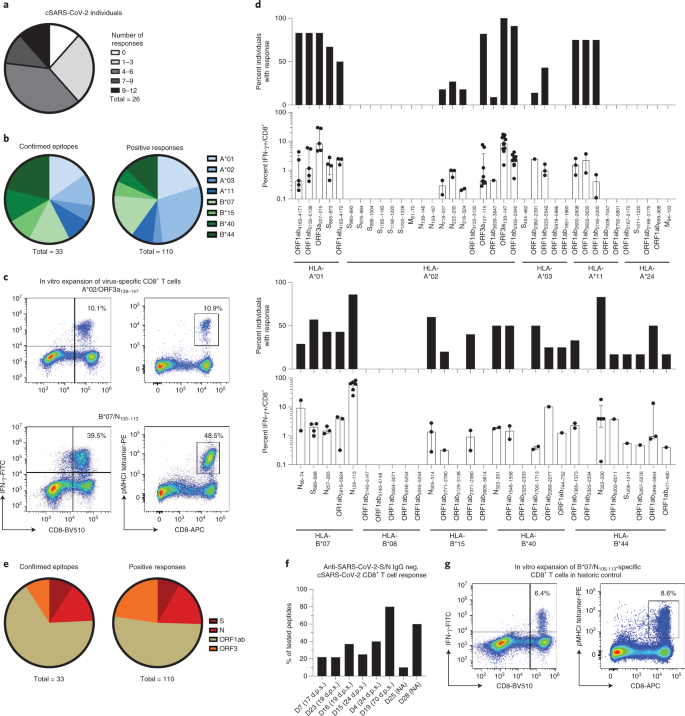
a , Test edilen birey başına tanınan epitopların sayısını gösteren Pasta grafik. b , HLA kısıtlamalarına göre tasvir edilen onaylanmış epitoplar ve toplam pozitif yanıtlar. c , A * 02 / ORF3a 139-147 - ve sonrasında B * 07 / N 105–113'e özgü CD8 + T hücrelerinin peptit yüklü majör histo-uyumluluk kompleksi sınıf I (pMHCI) tetramer boyamalarını ve IFN-γ üretimini gösteren temsili nokta grafikleri 14 günlük in vitro genişleme. Sayılar, CD8 + T hücreleri arasındaki ilgili pMHCI-tetramer + ve IFN-γ + hücrelerinin yüzdesine karşılık gelir . d, HLA-A- ve HLA-B ile sınırlı SARS-CoV-2 peptidlerine pozitif yanıt veren iyileşen SARS-CoV-2 bireylerinin yüzdesi ve CD8 + T hücrelerinin yüzdesi olarak bireysel yanıtların gücü IFN-γ + . e , SARS-CoV-2 genomu içindeki konumlarına göre tasvir edilen doğrulanmış epitoplar ve toplam pozitif yanıtlar. f , anti-SARS-CoV-2 S IgG'de (EUROIMMUN testi, saptama sınırı: 1,2 au ml −1 ) ve anti-SARS-CoV-2 N IgG'de (Mikrogen testi, saptama sınırı: 24 au ml) CD8 + T hücre yanıtları −1) hastanın HLA alelleri ile eşleşen test edilen tüm peptidlerden yanıtların yüzdesi olarak seronegatif iyileşen bireyler. Semptom başlangıcından sonraki günler (dps) gösterilir. g , 14 günlük in vitro genişletmeden sonra tarihi bir kontrolden alınan HLA-B * 07 / N 105–113'e özgü CD8 + T hücrelerinin pMHCI-tetramer boyama ve IFN-γ üretimini gösteren örnek nokta çizimleri . Sayılar, CD8 + T hücreleri arasındaki ilgili pMHCI-tetramer + ve IFN-γ + hücrelerinin yüzdesine karşılık gelir . Çubuk grafikler çeyrekler arası aralık (IQR) ile medyanı gösterir. n = 26 iyileşen birey. NA, uygulanamaz (asemptomatik).
Kaynak veriler
Tam boyutlu resim
Daha sonra, yukarıda tanımlanan optimal ve dominant epitopların altısını hedefleyen ex vivo SARS-CoV-2'ye özgü CD8 + T hücrelerini, influenza (FLU) -özel CD8 + T hücrelerine kıyasla peptid yüklü majör bir set kullanarak analiz ettik . hafif bir enfeksiyon seyrini takiben iyileşen 20 kişiden oluşan bir kohortta histo-uyumluluk kompleksi sınıf I (pMHCI) tetramerler. SARS-CoV-2'ye özgü CD8 + T hücrelerinin ex vivo frekanslarının düşük olduğu ortaya çıktığı için (Genişletilmiş Veri Şekil 3a ), tespit oranını artırmak ve müteakip derinlemesine fenotipiğe izin vermek için pMHCI tetramer bazlı zenginleştirme yaptık. analizi (Şekil 2a ). Zenginleştirmeden sonra, SARS-CoV-2'ye özgü CD8 +Neredeyse tüm test edilen iyileşme dönemindeki bireylerde T hücreleri (Şekil 2b ve Genişletilmiş Veri Şekil 3b ). SARS-CoV-2'ye özgü CD8 + T hücre frekansları, semptomların başlangıcıyla ilişkili olarak iyileşme sırasında analizin zaman noktasıyla ilişkili değildi (Şekil 2b ve Genişletilmiş Veri Şekil 3c ), bu da analiz edilen CD8 + T hücresi yanıtlarının geç kasılma / erken hafıza aşamasındaydı. A * 01 / ORF3a 207–215 , A * 01 / ORF1ab 4163–4172 , A * 02 / ORF3a 139–147 , B * 44: 03'ü hedefleyen SARS-CoV-2'ye özgü CD8 + T hücrelerinin hesaplanan ex vivo frekansları / N 322–330 ve B * 44: 03 / ORF1ab3946–3954 benzerdi (Şekil 2b ). B * 07 / N 105–113'ü hedefleyen CD8 + T hücreleri , diğer SARS-CoV-2'ye özgü CD8 + T hücre popülasyonlarına kıyasla biraz daha yüksek frekanslarda mevcuttu ve A * 02 / Flu-M1 58–66 düzeylerine ulaştı - spesifik CD8 + T hücreleri (Şekil 2b ). SARS-CoV-2'ye özgü CD8 + T hücre frekansları, sitomegalovirüs (CMV) A * 02 / pp65 496–503'e özgü ve Epstein – Barr virüsü (EBV) A * 02 / BMLF1 280–288'e özgü CD8'e kıyasla genellikle daha düşüktü + 'Şişirici bellek' ile ilişkili gizli viral enfeksiyonlar bağlamında T hücreleri CD8 +T hücre yanıtları 8 , ancak virüse özgü CD8 + T hücrelerinin frekanslarına benzer (hepatit B virüsü (HBV) A * 02 / pol 455-463 , HBV A * 02 / çekirdek 18–27 ve hepatit C virüsü (HCV ) A * 02 / NS3 1073–1081 ve HCV A * 02 / NS3 1406–1415 ) akut olarak çözülmüş HBV ve HCV enfeksiyonlarında (Genişletilmiş Veri Şekil 3d ). İyileşen bireylerde SARS-CoV-2'ye özgü CD8 + T hücre popülasyonları, saf (T naif ), merkezi bellek (T CM ), efektör bellek 1 (T EM1 ), efektör bellek 2 (T EM2 ), efektör bellek 3'ten oluşuyordu. (T EM3) ve hedeflenen epitoptan bağımsız olarak RA (T EPDK ) T hücresi alt kümelerini ifade eden terminal olarak farklılaştırılmış efektör bellek (Genişletilmiş Veri Şekil 3e, f ). Test edilen tüm SARS-CoV-2'ye özgü CD8 + T hücreleri arasında küçük bir T naif alt küme fraksiyonunun (medyan,% 3.9) varlığı, bu hücrelerin çoğunun enfeksiyon sırasında verimli bir şekilde hazırlandığı fikrini destekler. HLA-B-sınırlı SARS-CoV-2'ye özgü CD8 + T hücreleri ile karşılaştırıldığında HLA-A- , erken farklılaşmış T CM ve T EM1 alt kümesine doğru bir kayma gösterdi (Genişletilmiş Veri Şekil 3f ). CX 3 uygulanarak da benzer sonuçlar elde edildiBellek T hücresi alt kümelerinin CR1 tabanlı tanımı (Genişletilmiş Veri Şekil 3g ). Ek olarak, test edilen iyileşen bireylerden (Şekil 2c ) analiz edilen tüm SARS-CoV-2'ye özgü CD8 + T hücrelerinin t- dağıtılmış stokastik komşu gömme ( t -SNE) ve çok boyutlu ölçeklendirmesi (MDS), hedeflenen viral proteine kıyasla HLA kısıtlaması. HLA-A-kısıtlı SARS-CoV-2'ye özgü CD8 + T hücreleri, antijen tanıma ve daha az farklılaşmış hücreler ifade eden CD28 ve T hücresine özgü transkripsiyon ile ilişkili olan CD38, PD-1 ve TOX dahil bir işaret kümesi ile karakterize edilmiştir. faktör-1 (TCF-1) (Şekil 2d). Buna karşılık, CD45RA, CD57, KLRG-1, CD25, CX 3 CR1 ve yüksek T-bahis ifadesine dayalı olarak kümelenmiş HLA-B kısıtlı SARS-CoV-2'ye özgü CD8 + T hücreleri muhtemelen daha terminal olarak farklılaşmış efektör hücre durumunu yansıtır. (Şekil 2d ve Genişletilmiş Veriler Şekil 4a ). FLU-A * 02 / M1 58-66 -özel CD8 + T hücreleri, HLA-A ve HLA-B-kısıtlı SARS-CoV-2-spesifik CD8 + T hücrelerine kıyasla farklılıklar gösterdi (Şekil 2c, d ) . Özellikle, FLU A * 02 / M1 58–66 -spesifik CD8 +T hücreleri daha yüksek seviyelerde CD127 ve B hücresi lenfoma-2 (BCL-2) ifade etti, ancak TCF-1 ve Forkhead box protein O1 (FOXO1) benzer şekilde ifade edildi (Şekil 2e ve Genişletilmiş Veri Şekil 4b ). SARS-CoV-2'ye özgü CD8 + T hücrelerinin azaltılmış BCL-2 ekspresyonu, genel olarak bellek T hücresi alt kümeleri arasında en yüksek BCL-2 ifadesine sahip olan erken farklılaşmış T CM ve T EM1 alt kümeleri arasında en belirgindi (Genişletilmiş Veri Şekil . 4c ). SARS-CoV-2'ye özgü CD8 + T hücrelerinin BCL-2 ekspresyonu, semptomların başlangıcından sonraki süre ile ilişkilendirildi (Şekil 2f ). Böylece, SARS-CoV-2'ye özgü CD8 + T hücreleri muhtemelen dinlenme durumunda değil, uzun ömürlü bir bellek bölmesi oluşturma dinamik süreci içindeydi.
Şekil 2: SARS-CoV-2'ye özgü CD8 + T hücrelerinin ex vivo fenotipleri .
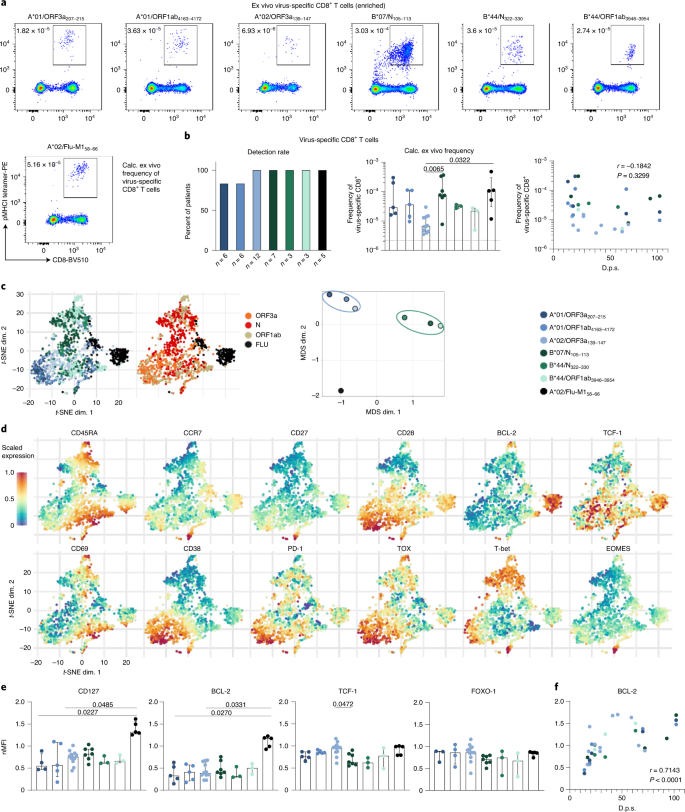
bir , Epitop spesifik CD8 + T hücrelerinin ex vivo olarak pMHCI tetramer bazlı zenginleşmesi (10 x 10 ila 20 sonra 6 PBMC periferal kan tek-çekirdekli hücreleri). Hesaplanan ex vivo frekanslar gösterilmektedir. b , Epitopa özgü T hücrelerinin saptama oranları (sol) ve frekansları (orta) ve bunların dps ile korelasyonu (sağ). c , HLA kısıtlaması (solda) ve hedeflenen viral proteinler (ortada) ile T hücrelerini karşılaştıran floresanla aktive edilen hücre sıralama (FACS) verilerinin t -SNE gösterimi. MDS analizi sonuçları, HLA-A- ve HLA-B-sınırlı epitopları karşılaştırarak da gösterilmiştir (sağda). d , t -SNE grafikleri üzerinde işaretlenen belirtilen belirteçlerin ifade seviyeleri (mavi, düşük; kırmızı, yüksek) .e , saf T hücrelerinin (nMFI) MFI'sine normalize edilmiş virüse özgü T hücreleri üzerindeki belirtilen markörlerin medyan floresan yoğunluğu (MFI). f , BCL-2 ifadesinin dps ile korelasyonu Çubuk grafikler IQR ile medyanı gösterir. n = 6 (A * 01 / ORF3a 207–215 , A * 01 / ORF1ab 4163–417 2 ), n = 12 (A * 02 / ORF3a 139–147 ), n = 7 (B * 07 / N 105–113 ), n = 3 (B * 44 / N 322–330 , B * 44 / ORF1ab 3946–3954 ), n = 5 (A * 02 / Flu-M1 58–66). Dunn'ın çoklu karşılaştırmalarını ve Spearman korelasyonunu içeren Kruskal-Wallis sıra-toplam testleri yapıldı.
Kaynak veriler
Tam boyutlu resim
SARS-CoV-2 enfeksiyonunda CD8 + T hücre yanıtının dinamiklerini daha iyi belirlemek için , tek hastalarda SARS-CoV-2'ye özgü CD8 + T hücrelerini uzunlamasına analiz ettik . Tanımlanmış bir enfeksiyon olayı olan bir HLA-B * 44: 03 + kişide SARS-CoV-2 enfeksiyonu öncesinde, sırasında ve sonrasında SARS-CoV-2'ye özgü CD8 + T hücre yanıtını uzunlamasına takip etme fırsatımız oldu ve belgelendi semptomların başlangıcı (Şekil 3a ). B * 44: 03 / N 322–330 - ve B * 44: 03 / ORF1ab 3946–3954 -spesifik CD8 + T hücreleri, enfeksiyondan yedi gün sonra (gün 1 (d1) semptom başlangıcından sonra açıkça genişledi; 3b ve Genişletilmiş Veriler Şekil.5a ). SARS-CoV-2 enfeksiyonundan önce her iki T hücresi popülasyonu da tespit edilemezdi (Şekil 3b ve Genişletilmiş Veri Şekil 5a ). Her iki T hücresi tepkisinin kinetiği benzerdi ve kasılma aşaması en az 70 gün sürdü, SARS-CoV-2'ye özgü CD8 + T hücreleri hala tespit edilebilir (~ 1 × 10 −5 frekanslar), semptom başlangıcından 104 gün sonra. Serum anti-SARS-CoV-2 N IgG titresi, semptom başlangıcından itibaren 29. günden itibaren saptama sınırına ulaştı ve anti-SARS-CoV-2 S IgG titresi, semptom başlangıcından 79 gün sonra saptama sınırının altına düştü (Şek. 3c ), virüse özgü CD8 +T hücreleri, bu aynı zaman noktalarında ve ayrıca daha sonraki takip zaman noktalarında zenginleştirmeden sonra saptanabilir kaldı. Daha sonra, SARS-CoV-2'ye özgü CD8 + T hücrelerinin derin profillemesini gerçekleştirdik , T hücre farklılaşması ve aktivasyon belirteçlerinin ekspresyonunu, transkripsiyon faktörlerini, inhibe edici reseptörleri ve akış ve kütle sitometrisi ile sağkalım faktörlerini değerlendirdik. B * 44: 03 / N 322–330 - ve B * 44: 03 / ORF1ab 3946–3954'e özgü CD8 + T hücrelerinin akış sitometri verilerini birleştiren difüzyon haritası , tüm SARS-CoV-2'ye özgü CD8 arasında sürekli bir ilişki olduğunu gösterdi +Enfeksiyon sırasında ve sonrasında toplanan T hücreleri. Semptom başlangıcından sonraki erken zaman noktalarından ve daha sonraki zaman noktalarından gelen hücreler, virüse özgü CD8 + T hücre yanıtının dinamik bir farklılaşmasını yansıtan difüzyon haritasındaki karşıt uçlarda lokalize olur (Şekil 3d ve Genişletilmiş Veriler Şekil 5b – d ) . Difüzyon haritası analizi tarafından önerilen farklılaşma programının doğrusallığına dayanarak , farklılaşma yörüngelerini daha ayrıntılı olarak anlamak için kütle sitometrisi verilerinin Wanderlust analizini 9 kullanarak tek hücreli yörünge tespiti gerçekleştirdik (Genişletilmiş Veri Şekil 6a ). Bu analiz, virüse özgü T hücrelerinin küçük bir fraksiyonunun semptom başlangıcından bir hafta sonra CD28 + ile tanımlandığını gösterdi.TCF-1 + CD127 + CD45RA + fenotipi, büyük efektör hücre havuzunun öncü popülasyonunu temsil edebilir (Genişletilmiş Veri Şekil 6a ). Bu Wanderlust (Genişletilmiş Veri Şekil 6a ) ve difüzyon haritası (Şekil 3d ) analizlerinin gösterdiği gibi, kütle sitometrisi verilerinin hızlandırılmış rafine topluluk bölümleme (PARC) 10 ile fenotipleme , SARS-CoV-2'ye özgü CD8'de önemli bir kaymayı doğruladı + Erken efektör durumundan T hücreleri (Ki-67 ile birlikte CD38, CD39 veya PD-1 ile karakterize edilir ), T CM'nin az katılımıyla bir T EM farklılaşma programına (CD45RA, CX 3 CR1, KLRG-1, CD57) doğruhücreler (Şekil 3e ve Genişletilmiş Veri Şekil 6b – d ). Bu değişiklikler ayrıca pMHCI olmayan tetramer + CD8 + T hücrelerinde de (Genişletilmiş Veri Şekil 6b, e ) belirgindi, bu da diğer epitopları hedefleyen virüse özgü tepkilerin geniş bir şekilde etkinleştirildiğini düşündürdü. Bu, bir HLA-A * 02 + bireyde (semptom başlangıcından 45 gün sonrasına kadar, Şekil 3f ) ve bir HLA-A * 01 + bireyde (en fazla 45 gün sonra) virüse özgü CD8 + T hücre yanıtlarının ek uzunlamasına analizleri ile desteklenmektedir . Semptom başlangıcından 21 gün sonra, Şekil 3g ) SARS-CoV-2 ile enfeksiyon öncesi ve sonrası aynı zamanda A * 02 / ORF3a 139-147'nin kuvvetli aktivasyonunu gösterir.-, A * 01 / ORF3a 207–215 - ve A * 01 / ORF1ab 4163–4172 -özel CD8 + T hücreleri (Şekil 3f, g ve Genişletilmiş Veri Şekil 7a ). İlk durumun B * 44: 03 / N 322–330 - ve B * 44: 03 / ORF1ab 3946–3954'e özgü CD8 + T hücrelerine benzer, A * 02 / ORF3a 139–147 -, A * 01 / ORF3a 207–215 - ve A * 01 / ORF1ab 4163-4172'ye özgü CD8 + T hücreleri, erken zaman noktalarında CD69 ve CD38 aktivasyon belirteçlerinin artmış ekspresyonunu sergilerken, BCL-2, CD127 ve CD57 ekspresyonu arttı ( Genişletilmiş Veri Şekil 7b). Anti-SARS-CoV-2 S ve N IgG, son iki vakada SARS-CoV-2 enfeksiyonu sırasında analiz edilen tüm zaman noktalarında tespit edilebilirdi, ancak bu bireyler semptom başlangıcından sonra sırasıyla 45. veya 21. güne kadar izlendi (Şekil . 3f, g ). Toplamda, bu veriler , farklı HLA alelleri tarafından kısıtlanan ve farklı epitopları hedefleyen SARS-CoV-2'ye özgü CD8 + T hücrelerinin, SARS-CoV-2 enfeksiyonu sırasında hızla aktive olduğunu ve genişlediğini göstermektedir.
Şekil 3: SARS-CoV-2'ye özgü CD8 + T hücre yanıtlarının boylamasına analizleri .
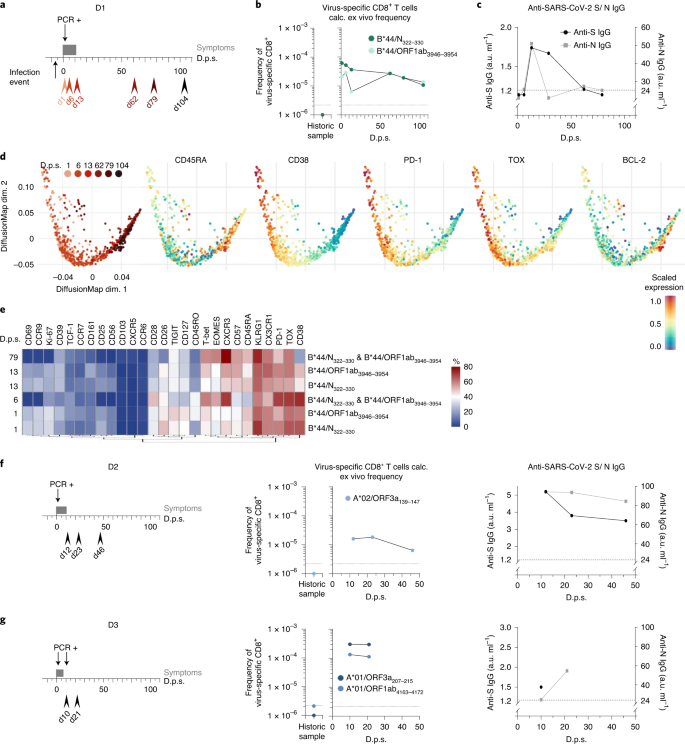
SARS-CoV-2 ile enfekte olan bireysel D1'in boylamsal analizleri gösterilir. a , Kanama tarihlerini (kırmızı ok uçları: açık kırmızı, erken zaman noktaları; koyu kırmızı, geç zaman noktaları), semptomları (koyu gri çubuk) ve dps'de gösterilen pozitif PCR testini gösteren Zaman Çizelgesi Bulaşma zaman noktası semptomdan altı gün önce belirtilir başlangıç. b , hesaplanan ex vivo olarak B frekansları * 44 / N 322-330 - dur ve B * 44 / ORF1ab 3946-3954 özgü CD8 + T hücreleri (10-20 x 10 6 PBMC'ler), tarihi bir numune ile bir araya DPS karşı gösterilir . Kesikli çizgi, algılama eşiğini gösterir. c , Anti-SARS-CoV-2 S IgG (siyah noktalar; EUROIMMUN testi, saptama sınırı: 1,2 au ml −1) ve anti-SARS-CoV-2 N IgG (gri kareler; Mikrogen testi, saptama sınırı: 24 au ml -1 ) dps'ye karşı gösterilir. Kesik çizgi, her iki testin saptama sınırını gösterir. d , dps ile ilişkili olarak B * 44 / N 322–330 - ve B * 44 / ORF1ab 3946–3954'e özgü CD8 + T hücrelerinin akış sitometri verilerini gösteren difüzyon haritası. Protein ekspresyon seviyeleri difüzyon haritasında grafiğe dökülür . e , SARS-CoV-2'ye özgü CD8 + T hücrelerinin, bir ısı haritası olarak görselleştirilen dinamik ifade profili . Veriler, kütle sitometrisi ile toplandı. Isı haritası renklendirmesi, virüse özgü CD8 + 'nın yüzdesini temsil ederBelirli bir belirteci ifade eden T hücreleri (mavi, düşük ifade; kırmızı, yüksek ifade). f , SARS-CoV-2 ile enfekte birey D2'nin boylamasına analizi. Zaman çizelgesi, dps'de (solda) gösterilen taşma tarihlerini, semptomları ve pozitif PCR testini gösterir. A * 02 / ORF3a 139-147 -spesifik T hücrelerinin (orta) ve anti-SARS-CoV-2 S IgG ve anti-SARS-CoV-2 N IgG'nin (sağda) frekansı, dps'de tarihi bir örnekle birlikte gösterilmektedir . g , SARS-CoV-2 ile enfekte birey D3'ün boylamasına analizi. Zaman çizelgesi, dps'de (solda) gösterilen taşma tarihlerini, semptomları ve pozitif PCR testini gösterir. A * 01 / ORF3a 207–215 - ve A * 01 / ORF1ab 4163–4172 sıklığı-özel T hücreleri (orta) ve anti-SARS-CoV-2 S IgG ve anti-SARS-CoV-2 N IgG (sağda) dps'ye karşı tarihi bir örnekle birlikte tasvir edilmiştir.
Kaynak veriler
Tam boyutlu resim
Daha sonra , in vitro olarak FLU'ya özgü bellek CD8 + T hücrelerine kıyasla SARS-CoV-2'ye özgü işlevsel kapasiteyi değerlendirdik (Şekil 4a ). İki haftalık in vitro genişlemeden sonra, SARS-CoV-2 B * 07 / N 105–113 - ve FLU A * 02 / M1 58–66 - diğerlerine kıyasla daha yüksek olan benzer CD8 + T hücrelerinin benzer frekanslarını tespit ettik. SARS-CoV-2'ye özgü CD8 + T hücrelerini test etti (Şekil 4b , sol). Bununla birlikte, virüse özgü CD8 + T hücrelerinin giriş sayısını dikkate alan bir ölçü olan genişleme endeksini analiz ederken, analiz edilen SARS-CoV-2- ve FLU'ya özgü CD8 + T hücrelerinin karşılaştırılabilir in vitro genişleme kapasitelerini gözlemledik ( İncir.4b , sağ). SARS-CoV-2'ye özgü CD8 + ' nın efektör fonksiyonları için bir tahmin elde etmek üzere, genişlemeden sonra virüse özgü CD8 + T hücrelerinin sıklığı ile ilişkili olarak sitokin üretimi (IFN-γ ve TNF) ve degranülasyonu (CD107a) analiz ettik. T hücreleri. SARS-CoV-2'ye özgü CD8 + T hücrelerinin fonksiyonel kapasitesi , hedeflenen epitoptan bağımsız olarak A * 02 / Flu-M1 58-66'ya özgü CD8 + T hücrelerine benzerdi (Şekil 4c ). Yukarıda açıklanan HLA-B * 44: 03 + bireyde (Şekil 3a ), SARS-CoV-2'ye özgü CD8 + ' nın in vitro fonksiyonel kapasitesinde büyük değişiklikler tespit etmedik .Semptom başlangıcından sonra 100 günden daha uzun bir zaman aralığı içindeki T hücresi popülasyonları (Genişletilmiş Veri Şekil 8a – c ). Birlikte, bu bulgular, SARS CoV-2 spesifik CD8 düşündürmektedir + T hücreleri, FLU-belirli CD8 karşılaştırılabilir fonksiyonel olarak yetkin niyetli bellek T hücrelerine dönüştürmek + klasik, tam fonksiyonel bellek T hücreleri temsil T hücreleri, 11 .
Şekil 4: SARS-CoV-2'ye özgü CD8 + T hücrelerinin in vitro işlevsel kapasitesi .
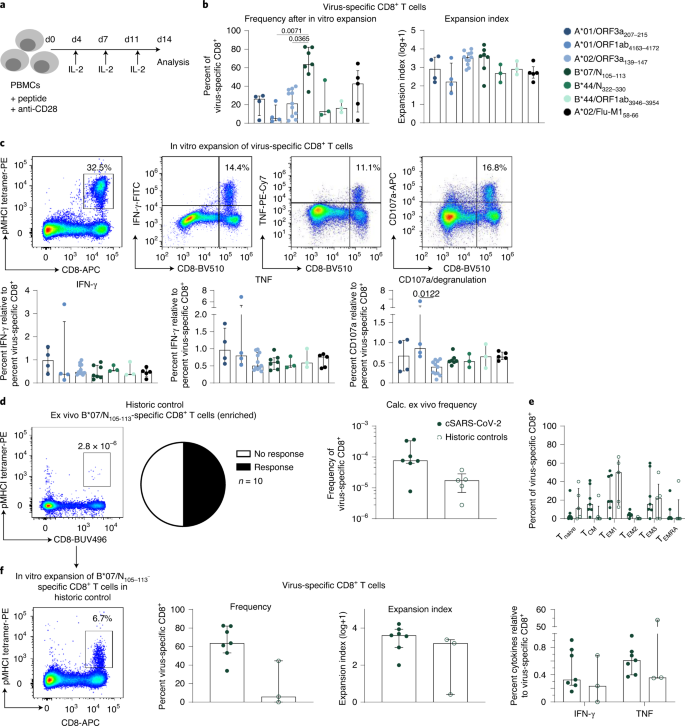
a , CD8 + T hücrelerinin peptide özgü in vitro genişlemesini gösteren İş Akışı . b , Virüse özgü CD8 + T hücrelerinin yüzdesi (sol) ve ilgili epitopa özgü CD8 + T hücrelerinin in vitro genişlemeden sonra genişleme indeksi (sağ) . c , SARS-CoV-2'ye özgü CD8 + T hücrelerini ve in vitro genişlemeden sonra IFN-γ-, TNF- ve CD107a üreten CD8 + T hücrelerini gösteren nokta çizimleri (üstte). Epitopa özgü CD8 + T hücrelerinin frekansına göre IFN-y-, TNF- ve CD107a üreten CD8 + T hücrelerinin yüzdeleri belirlendi (altta). d , Sol: Virüse özgü CD8'i gösteren nokta grafiği+ T hücreleri ex vivo olarak B * 07 / N sonra 105-113 tetramer bazlı zenginleşmesi (10 x 10 ila 20 ile 6 PBMC, sol). Virüse özgü CD8 + T hücrelerinin hesaplanan ex vivo frekansları gösterilir. Sağ: Test edilen hastaların olumlu yanıtlarının sayısını gösteren pasta grafik (ortada). İyileşme dönemindeki SARS-CoV-2 (cSARS-CoV-2) bireylere kıyasla tarihi kontrollerde B * 07 / N 105–113'e özgü CD8 + T hücrelerinin sıklığı (sağda). e , B * 07 / N'nin CD8 + T hücre alt kümelerinin (T naif , T CM , T EM1 , T EM2 , T EM3 ve T EPDK ) dağılımıİyileşen SARS-CoV-2 bireylere kıyasla tarihi kontrollerde 105–113'e özgü CD8 + T hücreleri. f , Sol: in vitro genişletmeden sonra virüse özgü CD8 + T hücrelerini gösteren nokta grafiği . CD8 + T hücreleri arasında pMHCI tetramer + hücrelerinin yüzdesi gösterilmektedir. Orta: Virüse özgü CD8 + T hücrelerinin frekans ve genişleme indeksi . Sağ: SARS-CoV-2 iyileşen bireylere kıyasla eski kontrollerde epitopa özgü CD8 + T hücrelerinin sıklığına göre IFN-y ve TNF'nin ifadesi . 'Soğuk algınlığı' koronavirüs enfeksiyonu geçmişi için tarihi kontroller seçildi. Çubuk grafikler IQR'li medyanları gösterir. İçinde b ,c , n = 6 (A * 01 / ORF3a 207–215 , A * 01 / ORF1ab 4163–417 2 ), n = 12 (A * 02 / ORF3a 139–147 ), n = 7 (B * 07 / N 105 –113 ), n = 3 (B * 44 / N 322–330 , B * 44 / ORF1ab 3946–3954 ), n = 5 (A * 02 / Flu-M1 58–66 ). Gelen d - f , n = 7 (iyileşme SARS CoV 2), n = 5 ( d , e ) ya da n = 3 ( f) (tarihi kontroller). İstatistiksel anlamlılık, Dunn'ın çoklu karşılaştırma testi dahil olmak üzere Kruskal-Wallis sıra-toplam testi ile değerlendirildi.
Kaynak veriler
Tam boyutlu resim
Son olarak, SARS-CoV-2 B * 07 / N 105–113'e özgü hafıza CD8 + T hücresi yanıtlarının SARS-CoV-2 iyileşen bireyler arasında farklılık gösterip göstermediğini değerlendirdik (semptom başlangıcından sonra 17 ila 100 gün arasında toplandı, Genişletilmiş Veri Şek. 3b ) ve soğuk koronavirüslere maruz kalan kişiler. Bunu yapmak için, anti-soğuk koronavirüs N için pozitif test yapmış 10 sağlıklı B * 07: 02 + bireyden alınan tarihi kan örneklerinde SARS-CoV-2 B * 07 / N 105–113'e özgü CD8 + T hücrelerini analiz ettik IgG (Şekil 4d ve Ek Tablo 2 ). PMHCI tabanlı zenginleştirmeden sonra, B * 07 / N 105–113'e özgü CD8 +T hücreleri ex vivo (5/10), ancak SARS-CoV-2 iyileşen bireylere kıyasla daha düşük frekanslarda (Şekil 4d ). SARS-CoV-2 iyileşme dönemindeki bireylerde analiz edilen B * 07 / N 105-113'e özgü CD8 + T hücresi popülasyonları muhtemelen geç kasılma / erken hafıza fazındadır, çünkü analizin zamanlaması ile ilgili frekans arasında hiçbir ilişki yoktur. tespit edilebilir (Genişletilmiş Veri Şekil 8d ). CD45RA / CCR7 / CD27 tabanlı T hücre alt küme dağılımı , SARS-CoV-2 iyileşen bireylerde daha fazla farklılaşmış T EM3 alt kümesine doğru hafif bir kayma ortaya çıkardı (Şekil 4e ). B * 07 / N 105–113'ün daha yüksek ex vivo frekansları ile birlikte bu daha fazla farklılaşma-özel CD8 + T hücreleri, heterolog uyarımı gösterebilir. Yine de, B * 07 / N 105-113'e özgü CD8 + T hücre frekansı, özellikle insanlarda 12 diğer viral enfeksiyonlar bağlamında çapraz reaktif virüse özgü CD8 + T hücre yanıtları ile karşılaştırıldığında düşüktü . Biz B genişlemesi ve sitokin üretiminde farklılık gözlenmedi * 07 / K 105 113 özgü CD8 + tarihi sağlıklı kontrol (Şek. Kıyasla SARS CoV 2 nekahet bireylerin T hücre popülasyonları 4f ).
Sonuç olarak, bulgularımız, önceden var olan ve indüklenen SARS-CoV-2'ye özgü CD8 + T hücrelerinin, bir bireyde olduğu kadar popülasyon düzeyinde de bağışıklık korumasının ana belirleyicilerini temsil ettiğini göstermektedir. SARS-CoV-2'ye özgü CD8 + T hücrelerinin, anti-SARS-CoV-2 S veya N IgG için seronegatif kişilerde saptanabilir olup olmadığı, SARS'taki CD8 + T hücre yanıtına kıyasla antikor yanıtının daha hızlı azaldığını gösterir. -CoV-2 enfeksiyonu, SARS-CoV-1 enfeksiyonu için bildirildiği gibi 13 , 14, daha ayrıntılı ve daha büyük kohortlarda araştırılması gerekiyor. Bu, farklı viral proteinleri hedefleyen SARS-CoV-2'ye özgü antikorların ve SARS-CoV-2'ye özgü T hücrelerinin ve B hücrelerinin 15 , 16 , 17 uzunlamasına yüksek çözünürlüklü analizini gerektirir . Bu çalışmada, SARS-CoV-2'ye özgü CD8 + T hücrelerinin yüksek çözünürlüklü ex vivo analizleri için, virüse özgü CD8 + T'nin patojenik ve koruyucu rolü hakkındaki soruyu yanıtlamaya yardımcı olacak deneysel araçlar oluşturduk. SARS-CoV-2 enfeksiyonundaki hücreler. Gelecekteki çalışmalarda, önceden var olan ve başlatılan SARS-CoV-2'ye özgü CD8 + ' daki farklılıkların değerlendirilmesi önemli olacaktır. T hücresi tepkileri, farklı enfeksiyon süreçleriyle bağlantılıdır.
Yöntemler
Çalışma grubu
Toplam 26 iyileşme dönemi olan birey (hafif bir SARS-CoV-2 enfeksiyonu seyrini takiben) ve sağlıklı bireylerin (uzunlamasına vakaların enfeksiyon öncesi örnekleri dahil) 25 yaş ve cinsiyet uyumlu tarihi kontrolü (Ağustos 2019'dan önce toplanmıştır) işe alınmıştır Freiburg Üniversitesi Tıp Merkezi'nde, Almanya. Hafif bir enfeksiyon seyri, solunum yetmezliği belirtileri olmayan klinik semptomlar olarak tanımlandı. Donör özellikleri Ek Tablo 2'de özetlenmiştir . SARS-CoV-2 enfeksiyonu, tipik semptomların varlığında orofaringeal sürüntüden ve / veya SARS-CoV-2 sivri IgG pozitif antikor testinden pozitif PCR testi ile doğrulanmıştır. pMHCI tetramer tabanlı virüse özgü CD8 + ' in manyetik boncuk zenginleştirmesiT hücreleri, 18 SARS-CoV-2 iyileşen bireyden ve 10 tarihi kontrolden alınan örneklerle gerçekleştirildi. HLA tiplemesi, yeni nesil sekanslama ile gerçekleştirildi ve Ek Tablo 2'de sunuldu . İnfluenza (FLU A * 02 / M1 58–66 ) -spesifik CD8 + T hücre karakterizasyonu, iyileşen beş SARS-CoV-2 bireyde gerçekleştirildi, CMV (A * 02 / pp65 496–503 ) - ve EBV (A * 02 / BMLF1 280–288 ) -spesifik CD8 + T hücreleri 23 sağlıklı bireyden ve HBV (A * 02 / pol 455–463 , A * 02 / core 18–27 ) -spesifik ve HCV (A * 02 / NS3 1073– 1081 , A * 02 / NS3 1406–1415 ) -spesifik CD8 +T hücreleri, akut olarak çözülen HBV ( n = 7) veya HCV ( n = 5) enfeksiyonu olan donörlerden analiz edildi . Tüm katılımcılardan yazılı bilgilendirilmiş onam alındı ve çalışma federal yönergelere, yerel etik komite yönetmeliklerine (Albert-Ludwigs-Universität, Freiburg, Almanya; no. 322/20) ve Helsinki Bildirgesi'ne (1975) göre yürütüldü.
PBMC izolasyonu
Venöz kan örnekleri etilendiamintetraasetik asit ile antikoagüle tüplere alındı. PBMC'ler, lenfosit ayırma ortamı yoğunluk gradyanları (Pancoll ayırma ortamı, PAN Biotech) ile izole edilmiş ve% 10 FCS,% 1 penisilin / streptomisin ve% 1,5 HEPES tamponu 1 mol l- 1 (tam ortam; tüm katkı maddeleri ile desteklenmiş RPMI 1640 ortamında yeniden süspanse edilmiştir) Thermo Scientific'ten) ve kullanılana kadar −80 ° C'de saklanır.
SARS-CoV-2'ye özgü CD8 + T hücresi epitoplarının tahmini
SARS-CoV-2'nin (GenBank: MN908947.3 ) tüm viral amino asit dizisi , Immune Epitope Database web sitesinde 18 ANN 4.0 ile in siliko peptit bağlanması için analiz edildi . HLA alelleri A * 01: 01, A * 02: 01, A * 03: 01, A * 11: 01, A * 24: 02, B * 07 için hesaplanan en iyi beş 8-, 9- veya 10-mer peptidi : 02, B * 08: 01, B * 15: 01, B * 40: 01 ve B * 44: 02/03 seçildi ve ileri analiz için sentezlendi. Ek olarak, Grifoni ve diğerleri tarafından tahmin edilen 13 epitop. Ek Tablo l'de özetlendiği gibi, SARS CoV-1'e yüksek dizi benzerliği olan alındı 1 6 .
Sıra hizalaması
Dizi homoloji analizleri, varsayılan ayarlarla 19 Clustal Omega 1.2.2 hizalaması kullanılarak Geneious Prime 2020.0.3'te ( https://www.geneious.com/ ) gerçekleştirildi . İnsan koronavirüslerinin referans genomları NCBI veritabanları 229E ( NC_002645 ), HKU1 ( NC_006577 ), NL63 ( NC_005831 ), OC43 ( NC_006213 ), MERS ( NC_019843 ) ve SARS-CoV-1 ( NC_004718) 'den indirildi). İnsan koronavirüslerinin proteinleri, sadece ilgili proteinin ilgili koronavirüste bir homologu olması durumunda homolojilerine (amino asit seviyesi) göre hizalandı. Onaylanmış SARS-CoV-2 epitopları daha sonra Ek Tablo 3'te özetlendiği gibi karşılık gelen protein hizalamasına eşleştirildi .
Peptidler ve tetramerler
Peptitler, modifiye edilmemiş bir N terminali ve standart Fmoc kimyası ve>% 70'lik bir saflık (Genaxxon Bioscience) ile amide edilmiş bir C terminali ile sentezlendi. HLA sınıf I easYmers (immunAware), üreticinin talimatlarına göre (A * 01 / ORF3a 207–215 , A * 01 / ORF1ab 4163–4172 , A * 02 / ORF3a 139–147 , B * 07 / N 105) peptit ile yüklendi –113 ) veya peptit yüklü monomerler olarak sipariş edilmiştir (B * 44: 03 / N 322–330 , B * 44: 03 / ORF1ab 3946–3954 ). SARS-CoV-2 peptit yüklü HLA sınıf I tetramerleri, biyotinlenmiş peptit yüklü HLA sınıf I easYmer'lerin fikoeritrin (PE) ile konjuge streptavidin (Agilent) ile üreticinin talimatlarına göre konjugasyonu yoluyla oluşturuldu. İnfluenzaya özgü HLA-A * 02 / M158–66 (GILGFVFTL) tetramer, CMV'ye özgü HLA-A * 02 / pp65 496–503 tetramer, EBV'ye özgü HLA-A * 02 / BMLF1 280–288 tetramer, HBV'ye özgü HLA-A * 02 / pol 455– 463 ve HLA-A * 02 / core 18–27 tetramerleri ve HCV'ye özgü HLA-A * 02 / NS3 1073–1081 ve HLA-A * 02 / NS3 1406–1415 tetramerleri daha önce tarif edildiği gibi oluşturuldu 20 .
Virüse özgü CD8 + T hücrelerinin in vitro genişlemesi ve efektör fonksiyonunun değerlendirilmesi
PBMC'ler (1-2 x 10 6 ) (0.5 ug mi epitopa spesifik peptidler (5 uM) ve anti-CD28 mAb ile uyarılmıştır -1 IU 20 (BD Biosciences) ile ve rIL2 içeren tam RPMI kültür ortamı içinde 14 gün süre ile genişletilmiş ml -1 , Miltenyi Biotec). Genleşme faktörü, daha önce 21 tarif edildiği gibi, peptit yüklü HLA sınıf I tetramer boyamasına dayalı olarak hesaplandı . Sitokin üretimi ve degranülasyonu, daha önce 21 tarif edildiği gibi epitopa özgü peptitlerle yeniden uyarıldıktan 5 saat sonra değerlendirildi .
Antijene özgü CD8 T hücrelerinin manyetik boncuk bazlı zenginleştirilmesi
Virüse özgü CD8 + T hücrelerinin zenginleştirilmesi, daha önce 22 açıklandığı gibi gerçekleştirildi . Kısaca, 1 x 2 bulundunuz 10 7 (% 16.5, CD8 ortalama ile PBMC + T hücreleri) PE-bağlanmış peptit yüklü HLA sınıf I tetramerleri ile 30 dakika boyunca etiketlenmiştir. Müteakip zenginleştirme, üreticinin protokolüne göre manyetik aktive edilmiş hücre ayırma (MACS) teknolojisi (Miltenyi Biotec) kullanılarak anti-fikoeritrin (PE) boncuklarla gerçekleştirildi. Multiparametrik akış sitometri analizi için zenginleştirilmiş SARS-CoV-2'ye özgü CD8 + T hücreleri kullanıldı. Virüse özgü CD8 + T hücrelerinin frekansları, daha önce 22'de açıklandığı gibi 2 × 10 −6 saptama sınırı ile hesaplandı .
Multiparametrik akış sitometrisi
WD1928, seyreltme 1:50), anti-IFN-γ-FITC (kat. No. 25723.11, seyreltme 1: 8), anti-IL-21-PE (kat. No. 3A3-N2.1, seyreltme 1:25 ), anti-PD-1-BV786 (kat. no. EH12.1, seyreltme 1:33) ve anti-TNF-PE-Cy7 (kat. no. Mab11, seyreltme 1: 400) (tümü BD Biosciences'tan elde edilmiştir) ; anti-BCL-2-BV421 (kat. no. 100, seyreltme 1: 200), anti-CD25-BV650 (kat. no. BC96, seyreltme 1:33), anti-CD38-BV650 (kat. no. HB- 7, seyreltme 1: 400), anti-CD57-BV605 (kat. No. QA17A04, seyreltme 1: 100), anti-CX3CR1-APC-eFluor660 (kat. No. 2A9-1, seyreltme 1:50), anti-CXCR3-PerCP-Cy5.5 (kat. No. G025H7, dilüsyon 1:33), anti-IL-2-PerCP- Cy5.5 (kat. No. MQ1-17H12, seyreltme 1: 100), anti-IL17A-BV605 (kat. No. BL168, seyreltme 1: 100), anti-PD-1-PE-Cy7 (kat. No. EH12.2H7, seyreltme 1: 200), anti-tavşan-PE-CF594 (kat. No. Poly4064, seyreltme 1: 200) ve anti-CD45RA-BV510 (kat. No. HI100, seyreltme 1: 200) (tümü elde edildi) BioLegend'den); anti-FOXO-1-saf (kat. no. C29H4, seyreltme 1:33) ve anti-TCF-1-AlexaFluor488 (kat. no. C63D9, seyreltme 1: 100) (Hücre Sinyali); anti-CD14-APC-eFluor780 (kat. no. 61D3, seyreltme 1: 400), anti-CD19-APC-eFluor780 (kat. no. HIB19, seyreltme 1: 400), anti-CD27-FITC (kat. no. 0323, seyreltme 1: 100), anti-KLRG-1-BV711 (kat. No. 13F12F2, seyreltme 1:50), anti-T-bet-PE-Cy7 (kat. No. 4B10, seyreltme 1: 200) ve anti-TOX-eFluor660 (kat. no. TRX10, seyreltme 1: 100) (eBioscience). Canlı / ölü ayrımı için sabitlenebilir bir canlılık boyası (eBioscience; APC-eFluor780 dilüsyonları 1: 200, 1: 400) veya ViaProbe (BD Biosciences; kat. No. 7-AAD, seyreltme 1:33) kullanıldı. Bir FoxP3 / transkripsiyon faktörü boyama tampon seti (eBioscience) ve fiksasyon / geçirgenleştirme solüsyonu kiti (BD Biosciences), üreticilerin sırasıyla intranükleer ve sitoplazmik moleküller için boyama talimatlarına göre kullanıldı. Hücrelerin% 2 paraformaldehit (PFA, Sigma) içinde sabitlenmesinin ardından FACSCanto II, LSRFortessa (BD Biosciences) veya CytoFLEX (Beckman Coulter) sistemleri üzerinde müteakip analizler yapıldı. Veri analizleri FlowJo 10 (TreeStar) ile yapıldı. 33) canlı / ölü ayrımcılık için kullanıldı. Bir FoxP3 / transkripsiyon faktörü boyama tampon seti (eBioscience) ve fiksasyon / geçirgenleştirme solüsyonu kiti (BD Biosciences), üreticilerin sırasıyla intranükleer ve sitoplazmik moleküller için boyama talimatlarına göre kullanıldı. Hücrelerin% 2 paraformaldehit (PFA, Sigma) içinde sabitlenmesinin ardından FACSCanto II, LSRFortessa (BD Biosciences) veya CytoFLEX (Beckman Coulter) sistemleri üzerinde müteakip analizler yapıldı. Veri analizleri FlowJo 10 (TreeStar) ile yapıldı. 33) canlı / ölü ayrımcılık için kullanıldı. Bir FoxP3 / transkripsiyon faktörü boyama tampon seti (eBioscience) ve fiksasyon / geçirgenleştirme solüsyonu kiti (BD Biosciences), üreticilerin sırasıyla intranükleer ve sitoplazmik moleküller için boyama talimatlarına göre kullanıldı. Hücrelerin% 2 paraformaldehit (PFA, Sigma) içinde sabitlenmesinin ardından FACSCanto II, LSRFortessa (BD Biosciences) veya CytoFLEX (Beckman Coulter) sistemleri üzerinde müteakip analizler yapıldı. Veri analizleri FlowJo 10 (TreeStar) ile yapıldı. Sigma) ardından FACSCanto II, LSRFortessa (BD Biosciences) veya CytoFLEX (Beckman Coulter) sistemleri üzerinde sonraki analizler yapılmıştır. Veri analizleri FlowJo 10 (TreeStar) ile yapıldı. Sigma) ardından FACSCanto II, LSRFortessa (BD Biosciences) veya CytoFLEX (Beckman Coulter) sistemleri üzerinde sonraki analizler yapılmıştır. Veri analizleri FlowJo 10 (TreeStar) ile yapıldı.
Multiparametrik akış sitometri verilerinin boyutsal olarak azaltılması
Multiparametrik akış sitometri verilerinin görselleştirilmesi, Bioconductor (sürüm (3.11)) CATALYST paketi 23 kullanılarak R sürüm 4.0.2 ile yapıldı . Analizler, iki panel için ayrı ayrı kapılı virüse özgü CD8 + T hücreleri üzerinde gerçekleştirildi . Panel 1'in analizi (transkripsiyon faktörleri) CD45RA, CCR7, CD27, CD28, BCL-2, TCF-1, CD69, CD38, PD-1, EOMES, T-bet ve TOX markörlerini içeriyordu. Panel 2'nin (yüzey markörleri) analizi CCR7, CD45RA, CD27, CD28, CD25, CD127, CD57, KLRG-1, CXCR3, PD-1, CX 3 üzerinde gerçekleştirildi.CR1 ve FOXO-1. Farklı örneklerin görselleştirilmesini kolaylaştırmak için boyutsallık indirgemeden önce, örnekte bulunan en az hücreye sahip hücrelerin alt örneklemesi gerçekleştirildi. Marker yoğunlukları, 150'lik bir kofaktör ile arcsinh (ters hiperbolik sinüs) ile dönüştürüldü. Dönüştürülen verilerde boyutsal azalma, t -SNE, MDS ve difüzyon haritası görselleştirme ile sağlandı .
Kütle sitometrisi
Kütle sitometri reaktifleri Fluidigm'den elde edildi veya bir MAXPAR X8 konjugasyon kiti (Fluidigm) kullanılarak izotop yüklü polimerlere özel konjugasyonla oluşturuldu. Kullanılan kütle sitometri antikorları Ek Tablo 2'de gösterilmektedir . Kütle sitometri tetramerleri, pMHCI monomerlerinin, bir Lightning bağlantı konjugasyon kiti (Expedon) kullanılarak Eu 151'e konjuge edilmiş streptavidin ile tetramerizasyonu ile oluşturuldu.Örnek barkodlama, anti-β2M barkodlar kullanılarak gerçekleştirildi, ardından hücreler havuzlandı ve daha önce açıklandığı gibi boyama gerçekleştirildi 24. Briefly, the single-cell suspension was pelleted, incubated with 20 μM Lanthanum-139 (Trace Sciences)-loaded maleimido-mono-amine-DOTA (Macrocyclics) in phosphate-buffered saline (PBS) for 10 min at room temperature (RT) for live/dead discrimination. Cells were washed in staining buffer and resuspended in staining buffer containing tetramers, incubated for 30 min at RT and washed twice. Cells were then resuspended in surface antibody cocktail, incubated for 30 min at RT, washed twice in staining buffer, pre-fixed with PFA (Electron Microscopy Sciences) 1.6%, washed, then fixed and permeabilized using FoxP3 staining buffer set (eBioscience) and stained intracellularly for 60 min at RT. Cells were further washed twice before fixation in 1.6% PFA solution containing 125 nM iridium intercalator overnight at 4 °C. Before data acquisition on a CyTOF Helios (Fluidigm), cells were washed twice in PBS and once in cell acquisition solution (CAS; Fluidigm). Mass cytometry data were analyzed after debarcoding and bead-based normalization. For analysis of mass cytometric data, samples were first gated on iridium intercalator positive, live, single CD45FlowJo (v10.6) kullanarak + CD3 + CD8 + T hücreleri. CD8 + T hücreleri daha sonra Omiq (Omiq) içinde analiz için ihraç edildi. Virüse özgü CD8 + T hücreleri, manuel geçitleme ile tanımlandı. Omiq'te optSNE 25 , PARC kümeleme analizi 10 ve Wanderlust yörünge analizi 9 kullanarak boyut küçültmeyi içeren bir iş akışı uygulandı. Kümeleme ve boyut küçültme analizi, CD45RA, CD45RO, CCR7, CD28, CD127, CD16, CD25, CD26, CD38, CD39, CD56, CD57, CD69, CD103, CD161, CCR6, CCR9, CXCR3, CXCR5, CXCR6, CX3CR1 temel alınarak yapılmıştır. , CRTH2, TCF-1, TOX, TIGIT, T-bet, EOMES, KLRG-1 ve PD-1. Daha fazla analiz ve ısı haritası görselleştirme, R (v4.0) (https://www.r-project.org ).
Serum IgG tayini
SARS-CoV-2'ye özgü antikorlar, anti-SARS-CoV-2 spike IgG'yi (anti-SARS-CoV-2 S IgG; saptama limiti, 1.2 au ml -1 ) tespit eden EUROIMMUN testi ve Mikrogen testi tespitiyle belirlendi. anti-SARS-CoV-2 nükleokapid IgG (anti-SARS-CoV-2 N IgG; saptama sınırı, 24 au ml -1 ), ürün talimatlarında açıklandığı gibi. Soğuk algınlığı koronavirüsleri 229E, NL63, OC43 ve HKU1 ile enfeksiyon, yaygın soğuk koronavirüsler 229E, NL63, OC43 ve HKU1'in anti-nükleokapside IgG'sini tespit eden Mikrogen rekomline testi ile belirlendi (tespit limiti, tedarikçi tarafından sağlanan kesme kontrolü ile tanımlandı).
İstatistik
İstatistiksel analiz, GraphPad Prism 8 ile gerçekleştirildi. İstatistiksel anlamlılık, Dunn'ın çoklu karşılaştırma testi ve Spearman korelasyonunu içeren Kruskal-Wallis testi ile değerlendirildi (* P <0.05; ** P <0.01; *** P <0.001; **** P <0.0001).
Raporlama Özeti
Araştırma tasarımı hakkında daha fazla bilgi, bu makale ile bağlantılı olan Doğa Araştırma Raporlama Özetinde mevcuttur .
Veri kullanılabilirliği
Bu çalışma için ham veriler, tamamlayıcı veri kümesi olarak https://github.com/sagar161286/SARSCoV2_specific_CD8_Tcells (akış sitometri verileri) ve https://flowrepository.org/experiments/3159 (kütle sitometri verileri) adreslerinde sağlanmaktadır. Tüm ek destekleyici ham ve analiz edilmiş veri ve materyal talepleri, talebin herhangi bir fikri mülkiyet veya gizlilik yükümlülüğüne tabi olup olmadığını doğrulamak için ilgili yazarlar tarafından incelenecektir. Yazıda yer almayan hastayla ilgili veriler, klinik muayenenin bir parçası olarak oluşturulmuştur ve hasta gizliliğine tabi olabilir. Paylaşılabilecek herhangi bir veri ve malzeme, bir malzeme aktarım sözleşmesi aracılığıyla yayınlanacaktır. Referans viral diziler (SARS-CoV-2 ( MN908947.3 ), 229E ( NC_002645), HKU1 ( NC_006577 ), NL63 ( NC_005831 ), OC43 ( NC_006213 ), MERS ( NC_019843 ) ve SARS-CoV-1 ( NC_004718 )) NCBI veri tabanından ( https: //www.ncbi.nlm.nih) indirildi. gov / ). In silico peptid bağlanması, Immune Epitope Database web sitesinde ( https://www.iedb.org/ ) ANN 4.0 ile analiz edildi . Kaynak veriler bu kağıtla sağlanır.
Kod kullanılabilirliği
Multiparametrik akış sitometrisi verilerinin analizini yeniden üretmek için R kodu https://github.com/sagar161286/SARSCoV2_specific_CD8_Tcells adresinde mevcuttur . Kütle sitometri verilerinin boyut küçültme, kümeleme ve yörünge analizi için ayrıntılı ayarlar, talep üzerine Omiq.ai platformu aracılığıyla kullanılabilir. Bu talep, herhangi bir fikri mülkiyet veya gizlilik yükümlülüğüne tabi olup olmadığını doğrulamak için ilgili yazarlar tarafından incelenecektir.
Referanslar
- 1.
Grifoni, A. vd. COVID-19 hastalığı olan insanlarda ve maruz kalmamış kişilerde SARS-CoV-2 koronavirüse karşı T hücre yanıtlarının hedefleri. Cell 181 , 1489–1501 (2020).
CAS makale Google Scholar
- 2.
Le Bert, N. vd. COVID-19 ve SARS vakalarında ve enfekte olmamış kontrollerde SARS-CoV-2'ye özgü T hücresi bağışıklığı. Nature 584 , 457–462 (2020).
makale Google Scholar
- 3.
Ni, L. vd. COVID-19 iyileşen bireylerde SARS-CoV-2'ye özgü humoral ve hücresel bağışıklığın tespiti. Bağışıklık 52 , 971–977 (2020).
CAS makale Google Scholar
- 4.
Sekine, T. vd. Asemptomatik veya hafif COVID-19'u olan iyileşme dönemindeki bireylerde sağlam T hücre bağışıklığı. Cell 183 , 158–168 (2020).
CAS makale Google Scholar
- 5.
Peng, Y. vd. COVID-19'u takiben Birleşik Krallık'ta iyileşen bireylerde SARS-CoV-2 tarafından indüklenen geniş ve güçlü bellek CD4 + ve CD8 + T hücreleri. Nat. Immunol. 21 , 1336–1345 (2020).
CAS makale Google Scholar
- 6.
Grifoni, A. vd. Bir dizi homolojisi ve biyoinformatik yaklaşım, SARS-CoV-2'ye bağışıklık tepkileri için aday hedefleri tahmin edebilir. Cell Host Microbe 27 , 671–680 (2020).
CAS makale Google Scholar
- 7.
Weiskopf, D. vd. Akut solunum sıkıntısı sendromlu COVID-19 hastalarında SARS-CoV-2'ye özgü T hücrelerinin fenotipi ve kinetiği. Sci. Immunol. 5 , eabd2071 (2020).
CAS makale Google Scholar
- 8.
Klenerman, P. Hafıza enflasyonunun (kademeli) yükselişi. Immunol. Rev. 283 , 99–112 (2018).
CAS makale Google Scholar
- 9.
Bendall, SC ve diğerleri. Tek hücreli yörünge tespiti, insan B hücresi gelişiminde ilerlemeyi ve düzenleyici koordinasyonu ortaya çıkarır. Celi 157 , 714–725 (2014).
CAS makale Google Scholar
- 10.
Stassen, SV ve diğerleri. PARC: Milyonlarca tek hücrenin fenotipik verilerinin ultra hızlı ve doğru kümelenmesi. Biyoinformatik 36 , 2778–2786 (2020).
makale Google Scholar
- 11.
van de Sandt, CE ve diğerleri. İnsan influenza A virüsüne özgü CD8 + T hücresi tepkisi uzun ömürlüdür. J. Infect. Dis. 212 , 81–85 (2015).
makale Google Scholar
- 12.
Urbani, S. vd. Şiddetli hepatit C virüsü enfeksiyonunda heterolog T hücresi bağışıklığı. J. Exp. Med. 201 , 675–680 (2005).
CAS makale Google Scholar
- 13.
Cao, WC, Liu, W., Zhang, PH, Zhang, F. & Richardus, JH İyileşmeden sonra SARS ile ilişkili koronavirüse karşı antikorların kaybolması. N. Engl. J. Med. 357 , 1162–1163 (2007).
CAS makale Google Scholar
- 14.
Ng, OW vd. SARS koronavirüsünü hedefleyen Bellek T hücresi tepkileri enfeksiyondan sonra 11 yıla kadar devam eder. Aşı 34 , 2008–2014 (2016).
CAS makale Google Scholar
- 15.
Hachim, A. vd. ORF8 ve ORF3b antikorları, erken ve geç SARS-CoV-2 enfeksiyonunun doğru serolojik belirteçleridir. Nat. Immunol. 21 , 1293–1301 (2020).
CAS makale Google Scholar
- 16.
Liu, L. vd. SARS-CoV-2 spike üzerindeki çoklu epitoplara karşı güçlü nötralize edici antikorlar. Nature 584 , 450–456 (2020).
CAS makale Google Scholar
- 17.
Juno, JA ve diğerleri. COVID-19 ile iyileşmiş hastalarda humoral ve dolaşımdaki yardımcı foliküler yardımcı T hücre yanıtları. Nat. Med. 26 , 1428–1434 (2020).
CAS makale Google Scholar
- 18.
Nielsen, M. vd. Yeni sekans temsillerine sahip sinir ağları kullanılarak T-hücresi epitoplarının güvenilir tahmini. Protein Sci. 12 , 1007–1017 (2003).
CAS makale Google Scholar
- 19.
Sievers, F. vd. Clustal Omega kullanarak hızlı, ölçeklenebilir yüksek kaliteli protein çoklu dizi hizalamaları oluşturma. Mol. Syst. Biol. 7 , 539 (2011).
makale Google Scholar
- 20.
Price, DA vd. Antijen için avidite, kalıcı DNA virüslerine özgü CD8 + T hücre popülasyonlarında klonal baskınlığı şekillendirir . J. Exp. Med. 202 , 1349–1361 (2005).
CAS makale Google Scholar
- 21.
Wieland, D. vd. TCF1 + hepatit C virüsüne özgü CD8 + T hücreleri, kronik antijen stimülasyonunun kesilmesinden sonra korunur. Nat. Commun. 8 , 15050 (2017).
makale Google Scholar
- 22.
Alanio, C., Lemaitre, F., Law, HK, Hasan, M. & Albert, ML İnsan antijenine özgü saf CD8 + T hücrelerinin numaralandırılması, korunan öncü frekanslarını ortaya çıkarır. Blood 115 , 3718–3725 (2010).
CAS makale Google Scholar
- 23.
Crowell, H., Zanotelli, V., Chevrier, S. & Robinson, M. CATALYST: Cytometry dATa anALYSis Tools. R paketi sürümü 1.12.2 (2020); https://github.com/HelenaLC/CATALYST
- 24.
Bengsch, B. vd. Epigenomik kılavuzlu kütle sitometri profili, tükenmiş CD8 T hücrelerinin hastalığa özgü özelliklerini ortaya çıkarır. Bağışıklık 48 , 1029–1045 (2018).
CAS makale Google Scholar
- 25.
Belkina, AC vd. T-dağıtılmış stokastik komşu gömme için otomatik optimize edilmiş parametreler, büyük veri kümelerinin görselleştirilmesini ve analizini iyileştirir. Nat. Commun. 10 , 5415 (2019).
makale Google Scholar
Referansları indir
Teşekkür
Tüm bağışçılara mevcut çalışmaya ve FREEZE-Biobank Biobanking Merkezi'ne (Freiburg Üniversitesi Tıp Merkezi) ve desteklerinden dolayı Tıp Fakültesi'ne katıldıkları için teşekkür ederiz. Çalışma Federal Eğitim ve Araştırma Bakanlığı (01KI1722 hibe, GK, MH, MP, MS ve RT'ye) ve Baden Eyaleti Bilim, Araştırma ve Sanat Bakanlığı'nın COVID-19 araştırma bursu tarafından finanse edildi. -Wuerttemberg (CNH ve BB'ye). Sunulan çalışma ayrıca CRC / TRR 179-Project 01 ve CRC 1160-Project A02 (to RT), CRC / TRR 179-Project 02 ve CRC 1160-Project A06 (to CNH), CRC / TRR 179-Project 04 tarafından desteklenmiştir. (TB'ye kadar), CRC / TRR 179-Proje 20 ve CRC 1160-Proje A02 (MH'ye), CRC / TRR 179-Proje 21, CRC 1160-Proje A03 ve BE-5496 / 5-1 (BB'ye) Alman Araştırma Vakfı (DFG; TRR 179 proje no. 272983813; CRC 1160 proje no. 256073931). MH bir Margarete von Wrangell bursu (Baden-Wuerttemberg Eyaleti) tarafından desteklenmiştir. DB ve TB, Freiburg Üniversitesi Tıp Fakültesi Berta-Ottenstein Programı tarafından desteklenmektedir. HEM, DFG ME3644 / 5-1 (proje no. 324736178) ve DAP, Wellcome Trust Kıdemli Araştırmacı Ödülü (100326 / Z / 12 / Z) tarafından desteklenmiştir. Fon kuruluşunun makaleyi yazma veya gönderme kararında hiçbir rolü yoktu.
Yazar bilgileri
Yazar notları
- Bu yazarlar eşit katkıda bulundu: Isabel Schulien, Janine Kemming, Valerie Oberhardt, Katharina Wild, Lea M. Seidel, Saskia Killmer.
- Bu yazarlar bu çalışmayı ortaklaşa denetlediler: Tobias Boettler, Bertram Bengsch, Robert Thimme, Maike Hofmann, Christoph Neumann-Haefelin.
Bağlantılar
- Tıp Bölümü II (Gastroenteroloji, Hepatoloji, Endokrinoloji ve Enfeksiyon Hastalıkları), Freiburg Üniversitesi Tıp Merkezi, Tıp Fakültesi, Freiburg Üniversitesi, Freiburg, Almanya
Isabel Schulien, Janine Kemming, Valerie Oberhardt, Katharina Wild, Lea M. Seidel, Saskia Killmer, Franziska Daul, Marilyn Salvat Lago, Annegrit Decker, Hendrik Luxenburger, Benedikt Binder, Dominik Bettinger, Oezlem Sogukpinar, Siegbert Rieg, Tobias Boettler, Bertram Bengsch , Robert Thimme, Maike Hofmann ve Christoph Neumann-Haefelin
- Biyoloji Fakültesi, Freiburg Üniversitesi, Freiburg, Almanya
Janine Kemming, Valerie Oberhardt, Lea M.Seidel ve Franziska Daul
- Kimya ve Eczacılık Fakültesi, Freiburg Üniversitesi, Freiburg, Almanya
Katharina Vahşi
- SGBM - Spemann Graduate School of Biology and Medicine, University of Freiburg, Freiburg, Almanya
Lea M.Seidel
- Sinyal Araştırma Merkezleri BIOSS ve CIBSS, Freiburg Üniversitesi, Freiburg, Almanya
Lea M.Seidel ve Bertram Bengsch
- Max Planck İmmünobiyoloji ve Epigenetik Enstitüsü, Freiburg, Almanya
Sagar
- IMM-PACT, Tıp Fakültesi, Freiburg Üniversitesi, Freiburg, Almanya
Hendrik Luxenburger & Benedikt Binder
- Berta-Ottenstein Programı, Tıp Fakültesi, Freiburg Üniversitesi, Freiburg, Almanya
Dominik Bettinger ve Tobias Boettler
- Viroloji Enstitüsü, Freiburg Üniversitesi Tıp Merkezi, Tıp Fakültesi, Freiburg Üniversitesi, Freiburg, Almanya
Marcus Panning, Daniela Huzly, Martin Schwemmle ve Georg Kochs
- Freiburg Üniversitesi Tıp Merkezi Hematoloji, Onkoloji ve Kök Hücre Transplantasyonu Anabilim Dalı, Tıp Fakültesi, Freiburg Üniversitesi, Freiburg, Almanya
Cornelius F. Waller
- Biobanking Merkezi - FREEZE-Biobanking, Freiburg Üniversitesi Tıp Merkezi, Tıp Fakültesi, Freiburg Üniversitesi, Freiburg, Almanya
Alexandra Nieters
- Tıp Bölümü III (Disiplinlerarası Tıbbi Yoğun Bakım), Freiburg Üniversitesi Tıp Merkezi, Tıp Fakültesi, Freiburg Üniversitesi, Freiburg, Almanya
Daniel Duerschmied
- Transfüzyon Tıbbı ve Gen Tedavisi Enstitüsü, Freiburg Üniversitesi Tıp Merkezi, Tıp Fakültesi, Freiburg Üniversitesi, Freiburg, Almanya
Florian Emmerich
- Alman Romatizma Araştırma Merkezi Berlin (DRFZ), Berlin, Almanya
Henrik E. Mei ve Axel Ronald Schulz
- Enfeksiyon ve Bağışıklık Bölümü, Cardiff Üniversitesi Tıp Fakültesi, Cardiff, İngiltere
Sian Llewellyn-Lacey & David A. Fiyat
- Sistem Bağışıklığı Araştırma Enstitüsü, Cardiff Üniversitesi Tıp Fakültesi, Cardiff, İngiltere
David A. Fiyat
Katkılar
IS, JK, VO ve KW, S., FD ve OSLMS yardımıyla planlanmış, gerçekleştirilmiş ve analiz edilmiş deneyler ve SK MSLAD, HL, B yardımıyla kütle sitometri verilerini gerçekleştirmiş ve analiz etmiştir.Binder, DB, SR, CFW, AN ve DD, bağışçıların işe alınmasından sorumluydu. HEM ve ARS, kütle sitometri analizi için barkod reaktifleri sağladı. SL-L. ve DAP influenza M1 58 sağladı/ A * 02 tetramerler. FE, yeni nesil dizileme ile dört basamaklı HLA tiplemesi gerçekleştirdi. MP ve DH, antikor testi yaptı. MS ve GK, virolojik uzmanlık sağladı ve verilerin yorumlanmasına katkıda bulundu. B. Bengsch tarafından tasarlanmış ve denetlenmiş kütle sitometrisi analizi. TB, RT, MH ve CN-H. çalışmayı tasarladı ve deneysel tasarım ve planlamaya katkıda bulundu. IS, JK, VO, RT, MH ve CN-H. verileri yorumladı ve yazıyı yazdı. CN-H., MH, RT, B. Bengsch ve TB son yazarlar paylaşılır.
|
|
 |
|
|
 |
 |
 |
FACEBOOK YORUM |
Yorumlarınızı
Facebook hesabınız üzerinden yapın hemen onaylansın... |
|
 |
|
|
 |
 |
 |
YORUMLAR |
Onay bekleyen yorum yok. |
|
 |
| |

Küfür, hakaret içeren; dil, din,
ırk ayrımı yapan; yasalara aykırı ifade ve beyanda bulunan ve tamamı büyük
harflerle yazılan yorumlar yayınlanmayacaktır.
|
|
|
|
|
| |
 |
|
| |
Bu haber henüz yorumlanmamış...
|
|
|
 |
 |
|




